Содержание
Оксид как строительный материал
Ключевые слова конспекта: оксиды, названия оксидов, классификация оксидов, получение оксидов, химические свойства.
Оксиды — сложные вещества, молекулы которых состоят из атомов двух химических элементов, один из которых — кислород. Атом кислорода в оксидах всегда имеет степень окисления –2.
К примеру, оксидом является соединение P2O5. А вот РН3 и H3PO4 — не являются оксидами, потому что в состав РН3 не входит атом кислорода, а в состав H3PO4 входят атомы трёх химических элементов, а не двух.
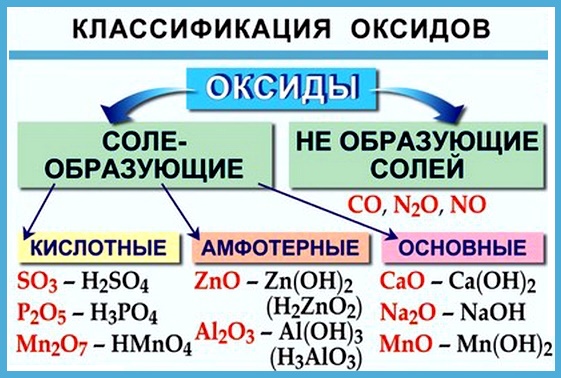
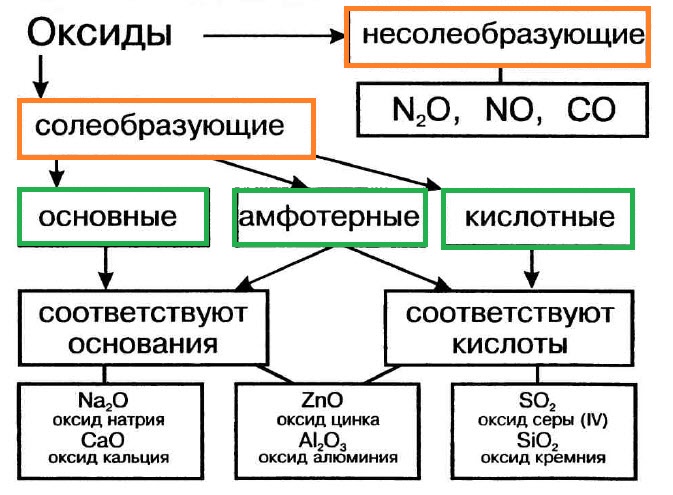
Оксиды подразделяют на солеобразующие (основные, кислотные, амфотерные) и несолеобразующие (безразличные). Особое положение у оксида «вода».
Названия оксидов
Названия оксидов состоят из двух слов: 1-е – «оксид», 2-е – название элемента в родительном падеже. Например, СаО – оксид кальция.
Если оксид образован химическим элементом с переменной валентностью, то после названия элемента, нужно указать его валентность. Например: Fe2О3 — оксид железа (III), FеО — оксид железа (II). Если у элемента постоянная валентность, то ее не обозначают в названии.
Некоторые оксиды имеют особые (тривиальные) названия: Н2О — вода, СО — угарный газ, СО2 — углекислый газ и др.

Если элемент образует оксиды в нескольких степенях окисления, то оксид с наименьшей валентностью – низший оксид, а с наибольшей – высший оксид. Так, оксид хрома (II) СгО – низший оксид, а оксид хрома (VI) СгO3 – высший оксид.
Классификация оксидов
Многие оксиды могут реагировать с кислотами или основаниями. Продуктами таких реакций являются соли. Поэтому такие оксиды называются солеобразующими.
Однако существует небольшая группа оксидов, которые к таким реакциям не способны. Такие оксиды называются несолеобразующими (безразличными): H2O, CO, N2O, NO, F2O. Безразличные оксиды образуются только неметаллами.
Вот некоторые правила образования солеобразующих оксидов:
- неметаллы образуют только кислотные оксиды;
- металлы могут образовывать разные оксиды — основные, амфотерные, кислотные — в зависимости от валентности металла.
Предсказать свойства оксида металла может помочь эта схема.
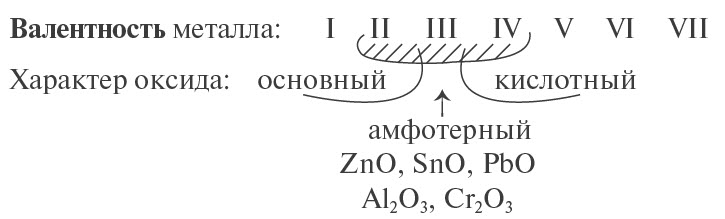
Основные оксиды металлов от кислотных оксидов металлов отличить легко: малая валентность металла — основный оксид; большая — кислотный. Валентность металлов в амфотерных оксидах — III. Но есть и исключения. Поэтому желательно запомнить формулы наиболее часто встречающихся амфотерных оксидов.
Схема определения типа оксида: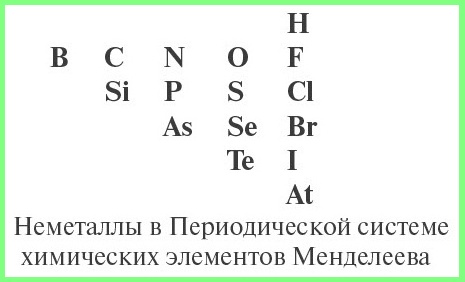
- определить, не является ли данный оксид несолеобразующим;
- определить, какой элемент входит в состав оксида: металл или неметалл, для чего нужно знать из таблицы Менделеева символы элементов — неметаллов.
- если в состав оксида входит атом неметалла — то оксид кислотный;
- для атома металла определить валентность, и по схеме определить характер оксида: основный, амфотерный или кислотный.
- Сг2О3 — амфотерный, так как хром — металл с низкой валентностью III;
- N2O3 — кислотный оксид, так как азот — неметалл;
- CrO3 — кислотный оксид, так как хром — металл с высокой валентностью VI.
Получение оксидов
Oксиды образуются при взаимодействии простых и сложных веществ с кислородом:
4Аl + 3O2 = 2Аl2O3; Si + O2 = SiO2;
SiH4 + 2O2 = SiO2 + 2Н2O; 2Н2S + 3O2 = 2SO2 + 2Н2O.
В реакциях с простыми веществами из одних оксидов могут получаться другие оксиды:
Fe2O3 + С = 2FeO + СО; 2CuO + Н2 = Сu2O + Н2O.
Oксиды образуются при разложении некоторых сложных веществ, обычно при нагревании:
СаСO3 = СаО + СO2; 2Аl(ОН)3 = Аl2O3 + 3Н2O.
Химические свойства оксидов
1. При разложении (при нагревании) неустойчивых оксидов – оксида серебра Ag2O и оксида ртути (II) HgO – образуется соответствующий металл и кислород:
2Ag2O = 4Ag + O2 ↑, 2HgO = 2Hg + O2 ↑.
2. Некоторые oксиды при нагревании образуют другие оксиды. Так, из красного оксида хрома (VI) получается зеленый оксид хрома (III): 4СrO3 = 2Сr2O3 + 3O2 ↑.
3. Некоторые oксиды металлов и неметаллов реагируют с водой:
СаО + Н2O = Са(ОН)2, SO3 + Н2O = Н2SO 4 .
4. Oксиды металлов обычно реагируют с оксидами неметаллов:
СаО + SO2 = CaSO3, MgO + СO2 = MgCO3.
Реакции оксидов с основаниями, кислотами и солями будут рассмотрены позже.
Конспект урока «Оксиды (названия, классификация, получение, свойства)».
Оксиды: классификация, получение и химические свойства
Оксиды — это сложные вещества, состоящие из атомов двух элементов, один из которых — кислород со степенью окисления -2. При этом кислород связан только с менее электроотрицательным элементом.
В зависимости от второго элемента оксиды проявляют разные химические свойства. В школьном курсе оксиды традиционно делят на солеобразующие и несолеобразующие. Некоторые оксиды относят к солеобразным (двойным).
Двойные оксиды — это некоторые оксиды , образованные элементом с разными степенями окисления.
Солеобразующие оксиды делят на основные, амфотерные и кислотные.
Основные оксиды — это оксиды, обладающие характерными основными свойствами. К ним относят оксиды, образованные атомами металлов со степень окисления +1 и +2.
Кислотные оксиды — это оксиды, характеризующиеся кислотными свойствами. К ним относят оксиды, образованные атомами металлов со степенью окисления +5, +6 и +7, а также атомами неметаллов.
Амфотерные оксиды — это оксиды, характеризующиеся и основными, и кислотными свойствами. Это оксиды металлов со степенью окисления +3 и +4, а также четыре оксида со степенью окисления +2: ZnO, PbO, SnO и BeO.
Несолеобразующие оксиды не проявляют характерных основных или кислотных свойств, им не соответствуют гидроксиды. К несолеобразующим относят четыре оксида: CO, NO, N2O и SiO.
Классификация оксидов

Получение оксидов
Общие способы получения оксидов:
1. Взаимодействие простых веществ с кислородом :
1.1. Окисление металлов: большинство металлов окисляются кислородом до оксидов с устойчивыми степенями окисления.
Например , алюминий взаимодействует с кислородом с образованием оксида:
Не взаимодействуют с кислородом золото, платина, палладий.
Натрий при окислении кислородом воздуха образует преимущественно пероксид Na2O2,
Калий, цезий, рубидий образуют преимущественно пероксиды состава MeO2:
Примечания : металлы с переменной степенью окисления окисляются кислородом воздуха, как правило, до промежуточной степени окисления (+3):
Железо также горит с образованием железной окалины — оксида железа (II, III):
1.2. Окисление простых веществ-неметаллов.
Как правило, при окислении неметаллов образуется оксид неметалла с высшей степенью окисления, если кислород в избытке, или оксид неметалла с промежуточной степенью окисления, если кислород в недостатке.
Например , фосфор окисляется избытком кислорода до оксида фосфора (V), а под действием недостатка кислорода до оксида фосфора (III):
Но есть некоторые исключения .
Например , сера сгорает только до оксида серы (IV):
Оксид серы (VI) можно получить только окислением оксида серы (IV) в жестких условиях в присутствии катализатора:
2SO2 + O2 = 2SO3
Азот окисляется кислородом только при очень высокой температуре (около 2000 о С), либо под действием электрического разряда, и только до оксида азота (II):
Не окисляется кислородом фтор F2 (сам фтор окисляет кислород). Не взаимодействуют с кислородом прочие галогены (хлор Cl2, бром и др.), инертные газы (гелий He, неон, аргон, криптон).
2. Окисление сложных веществ (бинарных соединений): сульфидов, гидридов, фосфидов и т.д.
При окислении кислородом сложных веществ, состоящих, как правило, из двух элементов, образуется смесь оксидов этих элементов в устойчивых степенях окисления.
Например , при сжигании пирита FeS2 образуются оксид железа (III) и оксид серы (IV):
Сероводород горит с образованием оксида серы (IV) при избытке кислорода и с образованием серы при недостатке кислорода:
А вот аммиак горит с образованием простого вещества N2, т.к. азот реагирует с кислородом только в жестких условиях:
А вот в присутствии катализатора аммиак окисляется кислородом до оксида азота (II):
3. Разложение гидроксидов. Оксиды можно получить также из гидроксидов — кислот или оснований. Некоторые гидроксиды неустойчивы, и самопроизвольную распадаются на оксид и воду; для разложения некоторых других (как правило, нерастворимых в воде) гидроксидов необходимо их нагревать (прокаливать).
гидроксид → оксид + вода
Самопроизвольно разлагаются в водном растворе угольная кислота, сернистая кислота, гидроксид аммония, гидроксиды серебра (I), меди (I):
2AgOH → Ag2O + H2O
2CuOH → Cu2O + H2O
При нагревании разлагаются на оксиды большинство нерастворимых гидроксидов — кремниевая кислота, гидроксиды тяжелых металлов — гидроксид железа (III) и др.:
4. Еще один способ получения оксидов — разложение сложных соединений — солей .
Например , нерастворимые карбонаты и карбонат лития при нагревании разлагаются на оксиды:
Соли, образованные сильными кислотами-окислителями (нитраты, сульфаты, перхлораты и др.), при нагревании, как правило, разлагаются с с изменением степени окисления:
Более подробно про разложение нитратов можно прочитать в статье Окислительно-восстановительные реакции.
Химические свойства оксидов
Значительная часть химических свойств оксидов описывается схемой взаимосвязи основных классов неорганических веществ.
Химические свойства основных оксидов
Подробно про химические свойства оксидов можно прочитать в соответствующих статьях:
Источник https://uchitel.pro/%D0%BE%D0%BA%D1%81%D0%B8%D0%B4%D1%8B/
Источник https://chemege.ru/oxides/
Источник
