Содержание
Стекло как строительный материал
Современная архитектура и гражданское строительство все чаще применяет стекло как конструкционный строительный материал. Привычное применение стекла в строительстве зданий — это заполнение проемов окон, дверей и фасадов. Однако иногда стекло включают в конструкции, где оно выполняет не только свою функцию светопрозрачного ограждения, а такие строительные элементы как полы, колонны и облицовочные панели (рисунок 1).
 |
Ниже представлен обзор процессов изготовления стекла, его состава, особенностей свойств и применения в строительстве как конструкционного материала. Применяемые термины соответствуют отечественным стандартам, в том числе, ГОСТ 32539-13 «Стекло и изделия из него. Термины и определения».
Еврокод для стекла
В настоящее время не существует международно признанных норм по проектированию стеклянных элементов конструкций, таких, как известные европейские стандарты Eurocode для других строительных материалов. В будущем планируется создать такой стандарт и для стекла [2].
Строительное силикатное стекло
Обычно, когда говорят о стекле, то имеют в виду группу силикатных стекол, которые составляют около 95 % общего производства стекла. Эти стекла массового производства содержать около 70 % двуокиси кремния, то есть кварцевого песка. Поскольку кварцевый песок имеет очень высокую температуру плавления (около 1700 º) к нему добавляют щелочные оксидные флюсы, которые снижают температуру плавления. Щелочноземельные оксиды добавляют для повышения твердости и химической стойкости стекла.
В строительной промышленности в основном применяются различные варианты натрий-кальций-силикатных стекол, которые имеют следующий химический состав [1]:
Диоксид кремния (SiO2): 69-74 %
Оксид кальция (CaO): 5-14 %
Оксид натрия (Na2O): 0-6 %
Оксид магния (MgO): 0-6 %
Прозрачность
Стекло является прозрачным для солнечного излучения в спектре видимого света и длинноволнового ультрафиолетового света (UV-A). Вместе с тем, стекло является непроницаемым для коротковолнового ультрафиолетового света (UV-B и UV-C).
Хрупкость
Стекло является типичным хрупким материалом. Максимальное удлинение при разрушении стекла составляет всего около 0,1 %. Отсутствие пластической деформации стекла не дает возможности предсказывать его разрушение, как это делается, например, для стали (рисунок 2).
 |
Рисунок 2 — Сравнение механического поведения стали и стекла при растягивающем нагружении [1]
Физические свойства
Натрий-кальций-силикатное стекло имеет следующие механические и физические свойства:
плотность (при 18 ºС): 2500 кг/м 3 ;
модуль упругости: 70000 Н/мм 2 ;
коэффициент Пуассона: 0,2;
средний коэффициент термического расширения: 9 × 10 -6 К -1
Прочность при растяжении
Теоретическая прочность стекла при растяжении, которая основана на физических расчетах, составляет от 5000 до 8000 Н/мм 2 . Однако из-за неизбежных поверхностных дефектов реальная прочность стекла значительно ниже. Поскольку высокая концентрация напряжений на трещинах не перераспределяется из-за отсутствия пластичности, то изгибная прочность отожженного стекла на практике снижается до 30-80 Н/мм 2 .
Изгибная прочность флоат-стекла зависит от многих факторов, среди которых:
размер поверхностной трещины;
сторона стекла по отношению к оловянной ванне;
размер стеклянного изделия или образца;
длительность приложения нагрузки;
влияние внешней среды, например, влаги.
Прочность при сжатии
В отличие от прочности при растяжении практическая прочность при сжатии достигает очень высоких величин. Независимо от наличия поверхностных дефектов прочность на сжатие силикатных стекол находится между 400 и 900 Н/мм 2 .
Химическая стойкость
Силикатные стекла обладают высокой стойкостью к воздействию многих химических веществ. Большинство кислот и щелочей не повреждают стекло. Единственным исключением является фтороводородная кислота, которая поэтому применяется для декоративного травления стекла.
Стекло обладает высокой стойкостью к воде, но постоянное присутствие воды может приводить к его повреждению и коррозии, что проявляется в виде матовых пятен.
Стекло может повреждаться в промышленной загрязненной атмосфере, содержащей аммиак, а также в результате контакта со штукатуркой, мокрым бетоном или щелочными чистящими средствами.
Производство стекла
Начальной стадией всех методов изготовления стекла является процесс плавления. Смесь исходных материалов засыпается на вход плавильной ванны, а на выходе их нее выходит вязкая стеклянная масса, из которой далее различными методами формуют листы стекла.
Флоат-стекло
До 1950-х годов все листовое стекло изготавливали путем непрерывных автоматизированных процессов прокатки или вытяжки, которые были аналогами древних ручных методов. Для получения листового стекла с высокими оптическими свойствами его подвергали длительному, трудоемкому и дорогому процессу шлифования и полировки.
Флоат-метод производства стекла, которые был разработан британской компанией Pilkington в 1950-тые годы, произвел переворот в стекольной промышленности. Этот метод обеспечивает высокое качество поверхности стекла без какой-либо дополнительной обработки.
Стекло подается при температуре около 1050 ºС из плавильной ванны в так называемую флоат-ванну, где оно разливается тонкой лентой на поверхности жидкого олова. Это обеспечивает листовому стеклу параллельность его сторон, плоские поверхности и полную, без искажений, прозрачность. В флоат-ванне стекло остывает до температуры около 600 ºС, при которой оно имеет достаточную прочность для того, чтобы извлечь его из оловянной ванны и передать в печь отжига и далее для дальнейшего охлаждения.
 |
Рисунок 3 — Производство флоат-стекла [1]
Флоат-процесс дает возможность получать стекло толщиной от 0,5 до 25 мм, но в строительстве обычно применяются стекла от 2 до 19 мм.
Прокатное стекло
Современное производство прокатного стекла включает формирование непрерывной ленты стекла при прохождении ее при температуре около 1200 ºС между двумя валками. Толщина прокатного стекла составляет от 3 до 15 мм. После прокатки стекло передается в печь отжига и затем для дальнейшей обработки (рисунок 4).
 |
Рисунок 4 — Производство прокатного стекла [1]
Светопроницаемость прокатного стекла хуже, чем флоат-стекла и зависит от толщины и поверхностной текстуры. Тем не менее, прокатное стекло находит свое применение в различных стеклянных изделиях. Рифленое и ажурное стекло получают при прокатке с применением текстурированного нижнего валка. Армированное стекло также получают при прокатке стекла путем введения проволочной сетки между валками.
Тянутое стекло
При изготовлении тянутого стекла непрерывную стеклянную ленту тянут вертикально вверх из расплава стекла. Этот процесс дает стеклу далеко не оптимальное оптическое качество, которое характерно для стекол исторических зданий. Поэтому этот метод применяют в основном для изготовления стекол при реставрации старинных зданий с намеренным введением поверхностных дефектов, характерных для старинного стекла. Толщина тянутого стекла составляет от 2 до 12 мм.
Бесцветное и цветное стекло
Силикатные стекла имеют слегка зеленоватый оттенок, который хорошо виден на кромке стекла (рисунок 5). Этот оттенок вызывается оксидом железа, который в различных пропорциях содержится в песке. Совершенно бесцветное стекло получают из исходной смеси с минимальным содержанием оксида железа. Это достигается путем специальной химической обработки исходной смеси.
Все листовые стекла могут быть окрашены. Это достигается путем добавки различных металлических оксидов в плавильную ванну или путем последующего процесса окрашивания.
Механическоя обработка
Стекло обычно режут путем нанесения глубокой царапины и затем легкого удара. Реже применяют пилы с алмазными наконечниками или водяную струю. Очень тонкие стекла можно резать лазером.
При резке стекла образуется довольно рваная кромка, которую часто шлифуют или полируют, чтобы удалить неровности и сколы (рисунок 5). Это делают, чтобы снизить возникающие на кромке растягивающие напряжения и, тем самым, повысить стойкость стекла к разрушению.
 |
Рисунок 5 — Флоат-стекло с различным качеством кромок (снизу вверх):
без обработки; шлифованная и полированная [1]
Сверление отверстий в стекле выполняют полыми сверлами с алмазными наконечниками, которые сверлят отверстие с обеих сторон стекла. Кроме того, для выполнения отверстий могут применяться водяные струи.
Нанесение покрытий
Нанесение покрытий из тонкого слоя металлов или оксидов металлов — это наиболее важный способ модификации стекла. Их наносят или вовремя изготовления стекла, то есть на еще мягкую и горячую поверхность, или в ходе отдельной операции уже после изготовления стекла. Покрытия, которые наносят в ходе изготовления стекла обычно значительно более прочные, чем те, которые наносят на уже готовые стекла.
Гнутое стекло
Гнутое стекло изготавливают при температуре стекла около 600 °С. Это делают или на горизонтальной роликовой машине, или в случае малых партий, с применением гравитационного метода. Гравитационный метод заключается в том, что плоский лист стекла кладут сверху выпуклой или вогнутой «матрицы» и затем нагревают. Под действием гравитации стекло принимает форму матрицы.
Закаленное стекло
Принцип действия закалки на прочность стекла заключается в том, что в его поверхностном слое создаются высокие сжимающие остаточные напряжения. Эти напряжения компенсируют возможные растягивающие напряжения в поверхности стекла и предотвращают рост трещин и разрушение стекла.
Стекло нагревают до температуры 620-650 °С и затем резко охлаждают струями воздуха с обеих сторон до комнатной температуры. В результате закалки в поверхностных слоях стекла образуются сжимающие остаточные напряжения величиной 100-150 Н/мм 2 (рисунок 6). Высокая энергия, которая запасается в этом стекле обеспечивает то, что при разрушении оно разбивается на мелкие кусочки (рисунок 7в), которые не представляют большой опасности.
 |
Рисунок 6- Остаточные напряжения в стеклах [2]
 |
Рисунок 7 — Типы разрушения стекол (не в масштабе):
а) отожженное флоат-стекло; б) термоупрочненное стекло; в) закаленное стекло [1]
Термоупрочненное стекло
Термоупрочненное стекло подвергается той же обработке, что и закаленное стекло, кроме того, что процесс охлаждения ведется более медленно. Это дает более низкие сжимающие напряжения, чем в закаленных стеклах (рисунок 6)
В отличие от закаленных стекол термоупрочненные стекла разрушаются с образованием довольно крупных кусков стекла, но значительно меньших, чем у отожженного флоат-стекла (рисунок 7). Это дает им преимущество при применении в многослойных стеклах: после разрушения они удерживаются полимерной пленкой на месте. Кроме того, термоупрочненное стекло можно подвергать механической обработке, например, сверлению, что невозможно для закаленных стекол.
Многослойное стекло
Многослойное безопасное стекло состоит из двух или нескольких листов стекла соединенных между собой поливинилбутиловой пленкой толщиной 0,38 мм. В отличие от закаленного безопасного стекла после разрушения многослойное стекло сохраняет часть своей несущей способности, а отдельные куски удерживаются пленкой на месте установки стекла.
Источники:
1. Glass in Building: Principles, Applications, Examples /Bernhard Weller et al, Detail Practice, 2009
2.Guidance for European Structural Design of Glass Components, 2014
ООО «Алюком»
г. Москва, ул. Нагатинская, д. 16, стр. 9, офис 2-5
Тел.: +7 (495) 268 0444
E-mail: info@alucom.ru
Производство и склад: Калужская обл., г. Малоярославец, ул. Калужская, 64.
Урок 33. Получение и применение оксидов
В уроке 33 «Получение и применение оксидов» из курса «Химия для чайников» узнаем как получать оксиды различными способами, а также познакомимся с широким спектром применения оксидов во всех отраслях промышленности и быта.

Получение оксидов
1. Взаимодействие простых веществ с кислородом
Некоторые оксиды образуются в результате сжигания в кислороде (или на воздухе) соответствующих простых веществ. Так можно получить оксиды углерода(IV), серы(IV), фосфора(V), магния и других неметаллов и металлов:
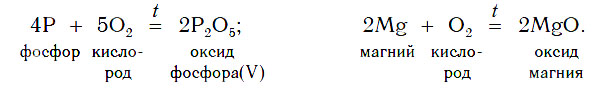
2. Взаимодействие сложных веществ с кислородом
Оксиды можно получать также сжиганием в кислороде (или на воздухе) некоторых сложных веществ, например:
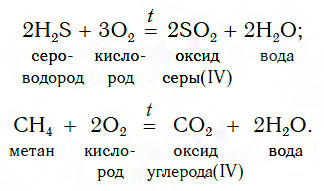
3. Термическое разложение нерастворимых оснований 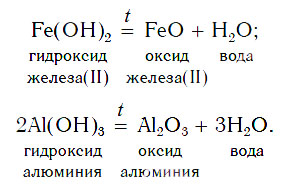
Применение оксидов
Один из наиболее широко использующихся оксидов — вода H2O, о применении которой в быту, технике и ромышленности вы уже знаете.
Разнообразное применение находят и некоторые другие оксиды. Так, например, из оксида железа(III) Fe2O3, входящего в состав железных руд, в промышленности получают железо, а из оксида алюминия Al2O3 — алюминий. Оксид алюминия применяют также для изготовления искусственных драгоценных камней — рубина и сапфира. Мелкие кристаллы этого оксида применяются также в производстве наждачной бумаги.
Оксид углерода(IV) (углекислый газ) используют в пищевой промышленности для изготовления всех газированных напитков, для увеличения срока сохранности фруктов и овощей. Этим веществом наполняют углекислотные огнетушители. Твердый оксид углерода(IV) под названием «сухой лед» (рис. 117) применяют для хранения мороженого, для сильного охлаждения различных материалов.

Достаточно широко используется и оксид серы(IV) SO2 (сернистый газ). Он находит применение в производстве серной кислоты, для дезинфекции складских помещений, уничтожения вредных насекомых и бактерий, отбеливания бумаги.
Оксид кремния(IV) SiO2 в виде кварцевого песка используется в производстве стекла и бетона. Вместе с оксидом свинца(II) PbO он применяется для изготовления полудрагоценных камней и украшений («кристаллы Сваровски»).
Оксид кальция СaO под названием «негашеная известь» применяют при изготовлении различных строительных материалов. Оксиды некоторых других металлов находят применение в производстве красок. Так, например, Fe2O3 используют для изготовления краски коричневого, Сr2O3 — зеленого, ZnO и TiO2 — белого цветов.
Краткие выводы урока:
- Оксиды образуются при взаимодействии кислорода с простыми и сложными веществами.
- Оксиды можно получить термическим разложением нерастворимых оснований.
- Оксиды находят широкое практическое применение в промышленности и в быту.
- Оксиды — вода H2O и углекислый газ СО2 — участвуют в процессе фотосинтеза.
Надеюсь урок 33 «Получение и применение оксидов» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии. Если вопросов нет, то переходите к следующему уроку.
Оксид цинка — важное в промышленности и медицине соединение
Оксид, или окись цинка — неорганическое вещество, востребованное в разных  областях производства, в медицине и в быту. Формула ZnO. Встречается в природе в виде минерала цинкита.
областях производства, в медицине и в быту. Формула ZnO. Встречается в природе в виде минерала цинкита.
Свойства
Белый мелкий кристаллический порошок, не растворимый в воде. Возгоняется при t +1800 °C, плавится при 2000 °C. Обладает полупроводниковыми свойствами, низкой теплопроводностью, поглощает ультрафиолет. Тонкие пленки обладают пьезоэлектрическими качествами. При нагревании становится желтым, после остывания опять белеет. Не горит. При контакте с кожей не вызывает раздражения, наоборот, обладает противовоспалительным и обеззараживающим действием.
Цинк окись — амфотерный оксид, вступающий в реакцию и с кислотами, и со щелочами. Реакция с кислотами приводит к получению солей, со щелочами — комплексных соединений гидроксоцинкатов. Взаимодействует с водородом, углеродом, раствором аммиака, угарным газом, метаном, карбидом кальция, ферросилицием. В результате сплавления с оксидами и гидроксидами металлов получаются цинкаты, а если сплавлять реагент с оксидом бора или оксидом кремния, то образуются борат и силикат цинка.
Меры предосторожности
 Оксид цинка считается малоопасным и малотоксичным веществом, не огне- и не взрывоопасным, IV степени опасности. Но пыль, взвесь, аэрозоль окиси цинка вызывают раздражение дыхательных путей и «литейную лихорадку». Проглатывание приводит к заболеваниям ЖКТ. На производствах, имеющих дело с большими количествами сыпучего реактива, с обжигом латуни, работники должны пользоваться респираторами, защитными очками, перчатками и спецобувью.
Оксид цинка считается малоопасным и малотоксичным веществом, не огне- и не взрывоопасным, IV степени опасности. Но пыль, взвесь, аэрозоль окиси цинка вызывают раздражение дыхательных путей и «литейную лихорадку». Проглатывание приводит к заболеваниям ЖКТ. На производствах, имеющих дело с большими количествами сыпучего реактива, с обжигом латуни, работники должны пользоваться респираторами, защитными очками, перчатками и спецобувью.
Хранить реагент следует в герметичной таре (полиэтиленовые и бумажные мешки или пакеты; стальные, картонные, фанерные бочки и контейнеры), так как доступ к углекислоте и влаге из воздуха может привести к перекристаллизации в углекислый цинк. Если из-за длительного неправильного хранения оксид цинка все же превратился в углекислый цинк, то ему можно вернуть первоначальные свойства, прокалив его. Окись цинка хранят в крытых, сухих складах без доступа солнечного света. Допустимый диапазон температур хранения — от -40 до +40 °С.
Применение оксида цинка
— Наполнитель и краситель для резины, полимеров, бумаги; вулканизирующий агент  для некоторых видов каучуков; катализатор в производства метанола; пигмент для лакокрасочной промышленности (цинковые белила).
для некоторых видов каучуков; катализатор в производства метанола; пигмент для лакокрасочной промышленности (цинковые белила).
— Используется при получении стекла и красок на базе жидкого стекла; составов-преобразователей ржавчины; фотокаталитических обеззараживающих покрытий стен и потолков в больницах; искусственной кожи, подошвенных резин.
— Наполнитель кремов, мазей, пудр и присыпок в косметологии и фармацевтике. Ингредиент кремов для загара, зубных паст.
— Минеральная добавка для животных кормов.
— Сырье в стекольной и керамической индустрии.
— В радиоэлектронной промышленности на основе окиси цинка изготавливают варисторы (полупроводниковые элементы, проводимость которых зависит от напряжения), люминофоры, голубые светодиоды, порошковые лазеры, тонкие пленки для сенсоров.
— В металлургии — для изготовления электрокабеля.
— В медицине применяется как антисептик, подсушивающее, вяжущее, адсорбирующее вещество. Его добавляют во многие наружные дерматологические средства для лечения экзем, пролежней, детской потницы, простого герпеса, ран, порезов, ожогов, язв.
— В стоматологии изготавливают абразивные материалы, добавляют в стоматологический цемент. В хирургии используются резинотехнические изделия на основе оксида цинка.
В нашем интернет-магазине вы можете купить оксид цинка высокого качества по доступной цене. Есть доставка и возможность самовывоза. Покупать у нас удобно и выгодно!
Оксиды. Классификация, свойства, получение, применение.
Оксиды — это неорганические соединения, состоящие из двух химических элементов, одним из которых является кислород в степени окисления -2. Единственным элементом, не образующим оксид, является фтор, который в соединении с кислородом образует фторид кислорода. Это связано с тем, что фтор является более электроотрицательным элементом, чем кислород.
 Данный класс соединений является очень распространенным. Каждый день человек встречается с разнообразными оксидами в повседневной жизни. Вода, песок, выдыхаемый нами углекислый газ, выхлопы автомобилей, ржавчина — все это примеры оксидов.
Данный класс соединений является очень распространенным. Каждый день человек встречается с разнообразными оксидами в повседневной жизни. Вода, песок, выдыхаемый нами углекислый газ, выхлопы автомобилей, ржавчина — все это примеры оксидов.
Классификация оксидов
Все оксиды, по способности образовать соли, можно разделить на две группы:
- Солеобразующие оксиды (CO2, N2O5,Na2O, SO3 и т. д.)
- Несолеобразующие оксиды(CO, N2O,SiO, NO и т. д.)
В свою очередь, солеобразующие оксиды подразделяют на 3 группы:
- Основные оксиды — (Оксиды металлов — Na2O, CaO, CuO и т д)
- Кислотные оксиды — (Оксиды неметаллов, а так же оксиды металлов в степени окисления V-VII — Mn2O7,CO2, N2O5, SO2, SO3 и т д)
- Амфотерные оксиды (Оксиды металлов со степенью окисления III-IV а так же ZnO, BeO, SnO, PbO)
Данная классификация основана на проявлении оксидами определенных химических свойств. Так, основным оксидам соответствуют основания, а кислотным оксидам — кислоты. Кислотные оксиды реагируют с основными оксидами с образованием соответствующей соли, как если бы реагировали основание и кислота, соответствующие данным оксидам: Аналогично, амфотерным оксидам соответствуют амфотерные основания, которые могут проявлять как кислотные, так и основные свойства:
Аналогично, амфотерным оксидам соответствуют амфотерные основания, которые могут проявлять как кислотные, так и основные свойства: Химические элементы проявляющие разную степень окисления, могут образовывать различные оксиды. Чтобы как то различать оксиды таких элементов, после названия оксиды, в скобках указывается валентность.
Химические элементы проявляющие разную степень окисления, могут образовывать различные оксиды. Чтобы как то различать оксиды таких элементов, после названия оксиды, в скобках указывается валентность.
CO2 – оксид углерода (IV)
Физические свойства оксидов
Оксиды весьма разнообразны по своим физическим свойствам. Они могут быть как жидкостями (Н2О), так и газами (СО2, SO3) или твёрдыми веществами (Al2O3, Fe2O3). Приэтом оснОвные оксиды, как правило, твёрдые вещества. Окраску оксиды также имеют самую разнообразную — от бесцветной (Н2О, СО) и белой (ZnO, TiO2) до зелёной (Cr2O3) и даже чёрной (CuO).
Химические свойства оксидов
Основные оксиды
Некоторые оксиды реагируют с водой с образованием соответствующих гидроксидов (оснований): Основные оксиды реагируют с кислотными оксидами с образованием солей:
Основные оксиды реагируют с кислотными оксидами с образованием солей: Аналогично реагируют и с кислотами, но с выделением воды:
Аналогично реагируют и с кислотами, но с выделением воды: Оксиды металлов, менее активных чем алюминий, могут восстанавливаться до металлов:
Оксиды металлов, менее активных чем алюминий, могут восстанавливаться до металлов:
Кислотные оксиды
Кислотные оксиды в реакции с водой образуют кислоты: Некоторые оксиды (например оксид кремния SiO2) не взаимодействуют с водой, поэтому кислоты получают другими путями.
Некоторые оксиды (например оксид кремния SiO2) не взаимодействуют с водой, поэтому кислоты получают другими путями.
Кислотные оксиды взаимодействуют с основными оксидами, образую соли: Таким же образом, с образование солей, кислотные оксиды реагируют с основаниями:
Таким же образом, с образование солей, кислотные оксиды реагируют с основаниями: Если данному оксиду соответствует многоосновная кислота, то так же может образоваться кислая соль:
Если данному оксиду соответствует многоосновная кислота, то так же может образоваться кислая соль: Нелетучие кислотные оксиды могут замещать в солях летучие оксиды:
Нелетучие кислотные оксиды могут замещать в солях летучие оксиды:
Амфотерные оксиды
Как уже говорилось ранее, амфотерные оксиды, в зависимости от условий, могут проявлять как кислотные, так и основные свойства. Так они выступают в качестве основных оксидов в реакциях с кислотами или кислотными оксидами, с образованием солей:  И в реакциях с основаниями или основными оксидами проявляют кислотные свойства:
И в реакциях с основаниями или основными оксидами проявляют кислотные свойства:
Получение оксидов
Оксиды можно получить самыми разнообразными способами, мы приведем основные из них.
Большинство оксидов можно получить непосредственным взаимодействием кислорода с химических элементом:  При обжиге или горении различных бинарных соединений:
При обжиге или горении различных бинарных соединений: Термическое разложение солей, кислот и оснований :
Термическое разложение солей, кислот и оснований : Взаимодействие некоторых металлов с водой:
Взаимодействие некоторых металлов с водой:
Применение оксидов
 Оксиды крайне распространены по всему земному шару и находят применение как в быту, так и в промышленности. Самый важный оксид — оксид водорода, вода — сделал возможной жизнь на Земле. Оксид серы SO3 используют для получения серной кислоты, а также для обработки пищевых продуктов — так увеличивают срок хранения, например, фруктов.
Оксиды крайне распространены по всему земному шару и находят применение как в быту, так и в промышленности. Самый важный оксид — оксид водорода, вода — сделал возможной жизнь на Земле. Оксид серы SO3 используют для получения серной кислоты, а также для обработки пищевых продуктов — так увеличивают срок хранения, например, фруктов.
Оксиды железа используют для получения красок, производства электродов, хотя больше всего оксидов железа восстанавливают до металлического железа в металлургии.
Оксид кальция, также известный как негашеная известь, применяют в строительстве. Оксиды цинка и титана имеют белый цвет и нерастворимы в воде, потому стали хорошим материалом для производства красок — белил.
Оксид кремния SiO2 является основным компонентом стекла. Оксид хрома Cr2O3 применяют для производства цветных зелёных стекол и керамики, а за счёт высоких прочностных свойств — для полировки изделий (в виде пасты ГОИ).
Оксид углерода CO2, который выделяют при дыхании все живые организмы, используется для пожаротушения, а также, в виде сухого льда, для охлаждения чего-либо.
Оксид как строительный материал
ХИМИЯ – это область чудес, в ней скрыто счастье человечества,
величайшие завоевания разума будут сделаны
именно в этой области.(М. ГОРЬКИЙ)
Таблица
Менделеева
Универсальная таблица растворимости
Коллекция таблиц к урокам по химии
Оксиды: классификация, номенклатура, свойства оксидов, получение, применение
Сегодня мы начинаем знакомство с важнейшими классами неорганических соединений. Неорганические вещества по составу делятся, как вы уже знаете, на простые и сложные.
I. Признаки классификации веществ
В истории развития химической науки существовали разные классификации веществ. Одним из первых признаков классификации веществ был источник их получения. По этому признаку вещества делили на растительные (полученные из растений), животные (полученные из животных) и минеральные (полученные из минералов).
Й.Я. Берцелиус объединил вещества, выделенные из растений и животных, в группу органических, а другую группу стали называть неорганическими веществами. Существует еще не одна классификация веществ: по агрегатному состоянию, по цвету, запаху и многим другим признакам.
Для нас же важно систематизировать вещества в соответствии с характерными для них химическими свойствами, которые определяются их составом. На этом основана современная классификация неорганических веществ.
Одной из первых была классификация веществ на простые и сложные по способности их к разложению. Если вещество удавалось разложить, его относили к сложным, если вещество не удавалось разложить ни при каких условиях – то к простым.
В дальнейшем установили, что способность к разложению связана с составом вещества. Простые вещества состоят из одного химического элемента, а сложные – из нескольких.
Современная классификация неорганических веществ
Простые вещества, как правило, подразделяют на два класса: металлы и неметаллы. Для металлов характерны такие физические свойства, как металлический блеск, высокая тепло- и электропроводность, пластичность. Свойства же неметаллов довольно разнообразны, но, как правило, они хрупкие и плохие проводники электричества.
Рис. 1. Классификация простых веществ
Классификация сложных веществ более сложная. Обычно выделяют четыре класса сложных веществ в зависимости от их состава и свойств: оксиды, основания, кислоты и соли.

II. Посмотрите видео презентацию
III. Классификация неорганических веществ
ОКСИД
КИСЛОТА
ОСНОВАНИЕ
СОЛЬ
А – кислотный остаток
ОН – гидроксильная группа
Сложные неорганические вещества подразделяют на четыре класса: оксиды, кислоты, основания, соли. Мы начинаем с класса оксидов.
Оксиды — это сложные вещества, состоящие из двух химических элементов, один из которых кислород, с валентность равной 2.
Лишь один химический элемент — фтор, соединяясь с кислородом, образует не оксид, а фторид кислорода OF2.
Называются они просто — «оксид + название элемента» (см. таблицу). Если валентность химического элемента переменная, то указывается римской цифрой, заключённой в круглые скобки, после названия химического элемента.
Формула
Название
Формула
Название
оксид углерода ( II )
оксид железа (III )
оксид азота ( II )
оксид марганца (VII )
IV. Классификация оксидов
Все оксиды можно разделить на две группы: солеобразующие (основные, кислотные, амфотерные) и несолеобразующие или безразличные.

Оксиды металлов МехОу
Оксиды неметалловнеМехОу
Основные
Кислотные
Амфотерные
Кислотные
Безразличные
I, II
Ме
V-VII
Me
> II
неМе
I, II
неМе
1). Основные оксиды – это оксиды, которым соответствуют основания. К основным оксидам относятся оксиды металлов 1 и 2 групп, а также металлов побочных подгрупп с валентностью I и II (кроме ZnO — оксид цинка и BeO – оксид берилия):

2). Кислотные оксиды – это оксиды, которым соответствуют кислоты. К кислотным оксидам относятся оксиды неметаллов (кроме несолеобразующих – безразличных), а также оксиды металлов побочных подгрупп с валентностью от V до VII (Например, CrO3-оксид хрома (VI), Mn 2O7 — оксид марганца (VII)):

3). Амфотерные оксиды – это оксиды, которым соответствуют основания и кислоты. К ним относятся оксиды металлов главных и побочных подгрупп с валентностью III , иногда IV , а также цинк и бериллий (Например, BeO, ZnO, Al2O3, Cr2O3).
4). Несолеобразующие оксиды – это оксиды безразличные к кислотам и основаниям. К ним относятся оксиды неметаллов с валентностью I и II (Например, N2O, NO, CO).
Вывод: характер свойств оксидов в первую очередь зависит от валентности элемента.
Например, оксиды хрома:
Классификация оксидов (по растворимости в воде)
Кислотные оксиды
Основные оксиды
Амфотерные оксиды
Растворимы в воде.
(не растворим в воде)
В воде растворяются только оксиды щелочных и щелочноземельных металлов
I «А» и II «А» групп,
исключение Be ,Mg)
С водой не взаимодействуют.
В воде не растворимы
Это интересно
Оксид циркония в медицине
Оксид циркония ZrО2 — исключительно интересный «биологический» материал. Его уже много лет применяют в качестве материала для протезирования тазобедренного сустава, а в последние годы — для создания зубных протезов. Биологическая переносимость этого оксида доказана, а такие свойства, как высокая прочность и высокая вязкость при изломе, делают его востребованным в тех областях, где необходима высокая стабильность в течение долгого времени при больших нагрузках.
Задания:
1. Выпишите отдельно химические формулы солеобразующих кислотных и основных оксидов.
Выпишите оксиды и классифицируйте их.
V. Получение оксидов
1. Горение веществ (окисление кислородом):
а) простых веществ: 2Mg +O2=2MgO
2.Разложение сложных веществ (используйте таблицу кислот, см. приложения) :
а) солей: СОЛЬ t = ОСНОВНЫЙ ОКСИД+КИСЛОТНЫЙ ОКСИД СaCO3= CaO+CO2
в) кислородсодержащих кислот: НnA = КИСЛОТНЫЙ ОКСИД + H2O
VI. Физические свойства оксидов
При комнатной температуре большинство оксидов — твердые вещества (СаО, Fe2O3 и др.), некоторые — жидкости (Н2О, Сl2О7 и др.) и газы (NO, SO2 и др.).
VII. Химические свойства оксидов
1. Химические свойства основных оксидов
1. Основной оксид + Кислотный оксид = Соль (р. соединения)
2. Основной оксид + Кислота = Соль + Н2О (р. обмена)
3. Основной оксид + Вода = Щёлочь (р. соединения)
2. Химические свойства кислотных оксидов
1. Кислотный оксид + Вода = Кислота (р. соединения)
2. Кислотный оксид + Основание = Соль + Н2О (р. обмена)
3. Основной оксид + Кислотный оксид = Соль (р. соединения)
4. Менее летучие вытесняют более летучие из их солей
3. Химические свойства амфотерных оксидов
Взаимодействуют как с кислотами, так и со щелочами.
ZnO + 2 NaOH = Na2ZnO2 + H2O (при сплавлении)
VIII. Применение оксидов
Некоторые оксиды не растворяются в воде, но многие вступают с водой в реакции соединения:
В результате часто получаются очень нужные и полезные соединения. Например, H2SO4 – серная кислота, Са(ОН)2 – гашеная известь и т.д.
Если оксиды нерастворимы в воде, то люди умело используют и это их свойство. Например, оксид цинка ZnO – вещество белого цвета, поэтому используется для приготовления белой масляной краски (цинковые белила). Поскольку ZnO практически не растворим в воде, то цинковыми белилами можно красить любые поверхности, в том числе и те, которые подвергаются воздействию атмосферных осадков. Нерастворимость и неядовитость позволяют использовать этот оксид при изготовлении косметических кремов, пудры. Фармацевты делают из него вяжущий и подсушивающий порошок для наружного применения.
Такими же ценными свойствами обладает оксид титана (IV) – TiO2. Он тоже имеет красивый белый цвет и применяется для изготовления титановых белил. TiO2 не растворяется не только в воде, но и в кислотах, поэтому покрытия из этого оксида особенно устойчивы. Этот оксид добавляют в пластмассу для придания ей белого цвета. Он входит в состав эмалей для металлической и керамической посуды.
Оксид хрома (III) – Cr2O3 – очень прочные кристаллы темно-зеленого цвета, не растворимые в воде. Cr2O3 используют как пигмент (краску) при изготовлении декоративного зеленого стекла и керамики. Известная многим паста ГОИ (сокращение от наименования “Государственный оптический институт”) применяется для шлифовки и полировки оптики, металлических изделий, в ювелирном деле.
Благодаря нерастворимости и прочности оксида хрома (III) его используют и в полиграфических красках (например, для окраски денежных купюр). Вообще, оксиды многих металлов применяются в качестве пигментов для самых разнообразных красок, хотя это – далеко не единственное их применение.
IX. Задания для закрепления
1. Выпишите отдельно химические формулы солеобразующих кислотных и основных оксидов.
Выберите из перечня: основные оксиды, кислотные оксиды, безразличные оксиды, амфотерные оксиды и дайте им названия.
3. Закончите УХР, укажите тип реакции, назовите продукты реакции
Источник https://alucom.ru/articles/zarubej_opit/steklo_kak_stroitelnyj_material
Источник https://kuzminki59.ru/svojstva-i-primenenie-oksidov/
Источник https://kardaeva.ru/88-dlya-uchenika/8-klass/180-oksidy-klassifikatsiya-nomenklatura-svojstva-oksidov-poluchenie-primenenie